锂离子电池在长期的存储过程中会面临着自放电过大的风险,特别是在较低的开路电压下,由于自放电过大可能导致锂离子电池的电压过低,引起负极负极的铜箔溶解等风险,由于溶解的铜元素在充电的过程中会再次在负极表面析出,产生的金属铜枝晶可能会刺穿隔膜,引起正负极短路,因此发生过度放电或者电压过低都会导致锂离子电池彻底失效。
目前对于过放电过程中锂离子电池内部发生的反应我们还不是特别清楚,为了了解这一反应过程,德国明斯特大学的JohannesKasnatscheew等人利用三电极体系对过放电过程中锂离子电池正负极电压的变化进行了详细的研究。
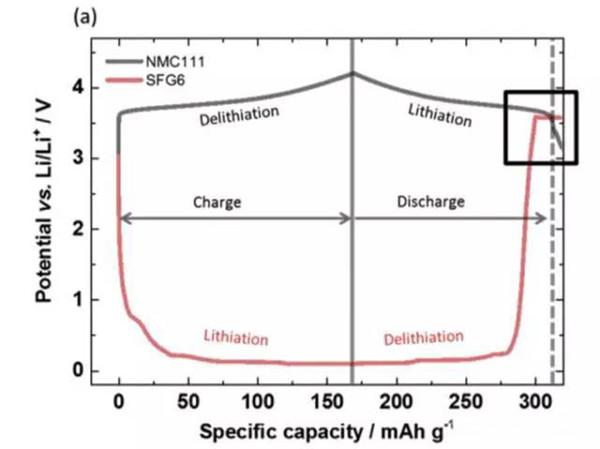
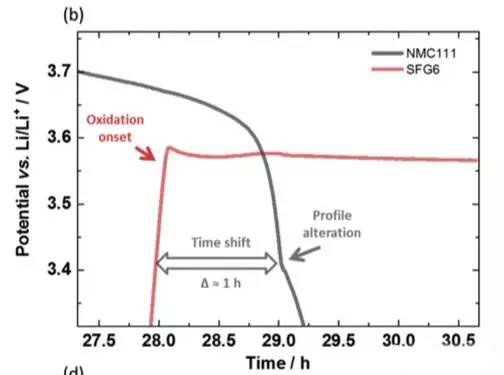
实验中JohannesKasnatscheew等采用的电池为NMC111/石墨体系,金属锂作为参比电极。从下图a中可以看到,在充电的过程中随着Li+从正极的脱出,正极的电势缓慢升高,负极电势在快速下降到1V一下,在放电的过程中正好相反,Li+从负极脱出回到正极,正极电势逐下降,当负极完全脱锂后,电势迅速升高,并在3.56V左右出现了一个电压平台,下图b为该区域的放大图,从正负极电压曲线上可以看到,正极电压曲线的变化相对于负极有大约1h的延迟,随后正极的电势也开始快速下降,正极电势低于负极石墨的电势。该电压曲线变化非常符合铜箔溶解的特点,铜箔中的铜元素首先被氧化为Cu1+,Cu1+迁移到正极表面并在正极表面还原,沉积为金属铜。
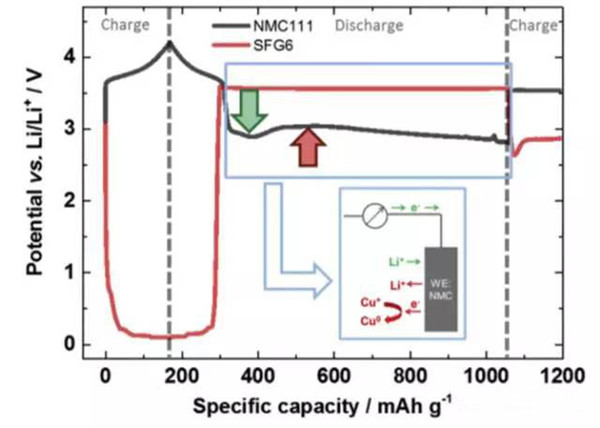
在整个过放电的过程中,正负极电势变化如下图所示,可以看到负极电势维持在3.56V左右,对应的为铜箔的溶解。而正极电势变化的趋势则比较有特别,随着铜箔的溶解,正极电势达到了一个最低点,随后有一些轻微的反弹,然后正极的电势开始缓慢向着2.8V截止电压下降,嵌锂造成NMC电势下降用绿色箭头进行了标识,铜在NMC表面沉积造成的电压下降用红色箭头进行了标识,Li+嵌入反应和铜的沉积同时在正极表面发生。
随着放电状态转变为充电状态,正负极的电势发生了反转,即正极电势高于负极。但是我们看到充电时正极的电势相当于充放电状态反转之前负极的电势,这表明此时正极发生的反应为其表面沉积的铜再次溶解,这也验证了负极铜箔在过放电过程中发生了溶解,并在正极表面发生了沉积。
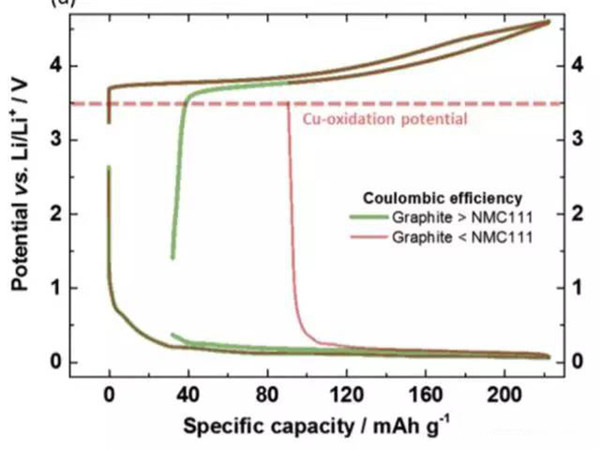
为了避免铜箔在放电的过程中发生氧化和溶解,就需要控制负极的电势不高于3.56VvsLi+/Li。在实际的过程中,负极的电势受到电池电压的控制,下图展示了当负极的首次效率高于正极,首次效率低于正极时,在充放电过程中的电势的变化。当负极的首次效率高于正极时,由于正极损失的容量较多,因此在放电时虽然正极已经完全嵌锂,但是负极仍然保有部分锂,因此负极的电势较低,也就不会发生铜箔溶解的问题。但是当负极的首次效率较低时,放电的过程中正极还没有完全嵌锂,此时负极的锂已经消耗完毕,特别是放电截止电压又比较低时,就有可能会导致负极的电势过高,导致铜箔的溶解。因此为了避免铜箔的溶解就需要对锂离子电池的放电截止电压进行谨慎的选择,避免负极的电势过高。
在电池的循环过程中,随着负极SEI膜的不断生长,消耗有限的Li+,可能会加剧负极Li+不足,导致其在放电的过程中电势过高,引起铜的溶解,因此需要对寿命末期的锂离子电池的截止电压进行格外的关注,一般来说将放电截止电压设的高一点有利于降低铜箔溶解的风险,因此JohannesKasnatscheew认为将截止电压设为3V可以将铜箔溶解的风险降到最低,提高锂离子电池的循环寿命。








